Istraživači su stvorili nanomašine koje koriste mehaničke molekularne pokrete da uđu i unište ćelije raka.
Rak je stanje u kome neke telesne ćelije rastu van kontrole i šire se na druge delove tela. Ćelije raka se neprestano dele, što ih dovodi do invazije okolnog tkiva i formiranja čvrstih tumora.
Većina tretmana raka uključuje ubijanje ćelija raka.
Prema procenama iz 2020. godine, u SAD je dijagnostikovano 1,8 miliona novih slučajeva raka, a 600.000 ljudi je preminulo od tog stanja.
Rak dojke, rak pluća, rak prostate i rak debelog creva su najčešći karcinomi. Prosečna starost pacijenata sa rakom nakon dijagnoze je 66 godina, a osobe između 65 i 74 godine čine 25% svih novih dijagnoza raka.
Proteini su uključeni u svaki biološki proces i koriste energiju u telu da menjaju svoju strukturu mehaničkim pokretima. Oni se nazivaju biološkim nanomašinama jer čak i manje strukturne promene u proteinima imaju značajan uticaj na biološke procese.
Da bi sproveli kretanje u ćelijskom okruženju, istraživači su se fokusirali na razvoj nanomašina koje imitiraju proteine.
Međutim, ćelije koriste različite mehanizme da se odbrane od dejstva ovih nanomašina. Ovo ograničava svako relevantno mehaničko kretanje nanomašina koje bi se mogle koristiti u medicinske svrhe.
Istraživački tim na čelu sa dr Joungdo Jeongom iz Centra za napredno biomolekularno prepoznavanje pri Korejskom institutu za nauku i tehnologiju (KIST) objavio je o razvoju nove biohemijske nanomašine koja prodire u ćelijsku membranu i ubija ćeliju putem molekularnih pokreta savijanje i odvijanje u određenim ćelijskim sredinama, kao što su ćelije raka.
Sarađivali su sa timovima profesora Sang Kju Kvaka sa Škole za energetiku i hemijsko inženjerstvo i profesora Ja-Hjoung Rjua sa Odseka za hemiju na Ulsanskom nacionalnom institutu za nauku i tehnologiju (UNIST) i dr Čeku Kim iz fuzione biotehnologije.
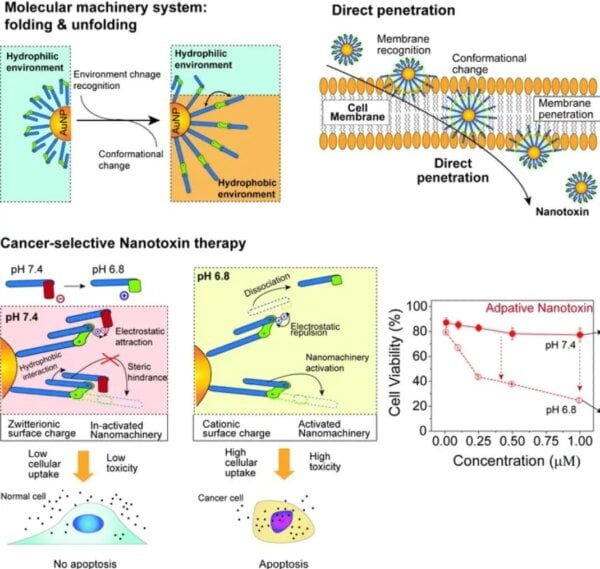
Zajednički istraživački tim fokusirao se na hijerarhijsku strukturu proteina, u kojoj su osa velike strukture i mobilne jedinice hijerarhijski odvojene.
Dakle, samo određeni delovi mogu da se kreću oko ose.
Većina postojećih nanomašina je dizajnirana tako da su mobilne komponente i osa velike strukture prisutne na istom sloju. Dakle, ove komponente se podvrgavaju istovremenom kretanju, što komplikuje željenu kontrolu određenog dela.
Hijerarhijska nanomašina je proizvedena sintezom i kombinovanjem zlatnih nanočestica prečnika 2 nm sa molekulima koji se mogu savijati i odvijati na osnovu okolnog okruženja.
Ova nanomašina se sastojala od mobilnih organskih molekula i neorganskih nanočestica da bi funkcionisale kao strukture velike osovine i definisale kretanje i pravac na takav način da je, kada je stigla do ćelijske membrane, rezultirala mehaničkim pokretom savijanja/odvijanja što je dovelo do toga da nanomašina direktno prodre u ćelije, uništavajući organele i izazivajući apoptozu.
Ova nova metoda direktno ubija ćelije raka mehaničkim pokretima bez lekova protiv raka, za razliku od nanonosaca tipa kapsula koji isporučuju terapeutske lekove.
Nakon toga, reza molekul je navučena na nanomašinu da kontroliše mehaničko kretanje da se selektivno ubije ćelije raka.
Reza molekul sa navojem je dizajniran da se oslobađa samo u okruženju sa niskim pH.
Stoga, u normalnim ćelijama sa relativno visokim pH (približno 7,4), pokreti nanomašina su bili ograničeni i nisu mogli da prodru u ćeliju. Međutim, u okruženju sa niskim pH oko ćelija raka (približno 6,8), reza molekula su bili odvezani, izazivajući mehaničko kretanje i prodiranje u ćelije.
Dr Jeong je rekao:
Razvijena nanomašina je inspirisana proteinima koji obavljaju biološke funkcije menjajući svoj oblik na osnovu okruženja. Predlažemo novu metodu direktnog prodiranja u ćelije raka da ih ubijemo mehaničkim pokretima molekula pričvršćenih za nanomašine bez lekova. Ovo bi mogla biti nova alternativa za prevazilaženje neželjenih efekata postojeće hemoterapije.
Referenca: “Stimuli-Responsive Adaptive Nanotoxin to Directly Penetrate the Cellular Membrane by Molecular Folding and Unfolding” by Youngdo Jeong, Soyeong Jin, L. Palanikumar, Huyeon Choi, Eunhye Shin, Eun Min Go, Changjoon Keum, Seunghwan Bang, Dongkap Kim, Seungho Lee, Minsoo Kim, Hojun Kim, Kwan Hyi Lee, Batakrishna Jana, Myoung-Hwan Park, Sang Kyu Kwak, Chaekyu Kim and Ja-Hyoung Ryu, 2. Mart 2022, Journal of the American Chemical Society.
DOI: 10.1021/jacs.2c00084
Pratite nas na društvenim mrežama Fejsbuk i Telegram